مهمتنا
لتعزيز أبحاث علوم الحياة من خلال تقنيات الببتيد المبتكرة وخدمة العملاء الاستثنائية.
رؤيتنا
أن نصبح شركة رائدة معترف بها عالميًا في مجال تصنيع الببتيد ومجالات التكنولوجيا الحيوية ذات الصلة.
في عصير المعدة البشري، يكون BPC 157 مستقرًا لأكثر من 24 ساعة، وبالتالي فهو يتمتع بتوافر حيوي جيد عن طريق الفم (يتم إعطاؤه بمفرده دائمًا) وتأثيرات مفيدة في الجهاز الهضمي بأكمله. يعد هذا تمييزًا مهمًا عن الببتيدات القياسية الأخرى، والتي تعتمد وظيفيًا على إضافة الناقل أو يتم تدميرها بسرعة في عصير المعدة البشري. وبالتالي، يُقترح أن يكون BPC 157 المستقر وسيطًا للحماية الخلوية لروبرت، والتي تحافظ على سلامة الغشاء المخاطي المعدي المعوي. نقترح أن مساهمة BPC 157 في الحماية الخلوية لروبرت - أي القدرة على مواجهة آفات المعدة الأساسية الناجمة عن الكحول، والتي أطلق عليها روبرت الحماية الخلوية - والقدرة على مواجهة الآفات الناشئة عن الاتصال الضار المباشر للعامل الضار مع الخلية تمثل الاتصال المحيطي بين الأمعاء ومحور الدماغ.
أفاد بيروفيتش أن BPC 157 له تأثير علاجي ملحوظ يتعلق بتعافي الفئران المصابة بإصابة في النخاع الشوكي مع شلل الذيل (إصابة ضغط لمدة دقيقة واحدة في الحبل الشوكي العجزي [S2 – Co1]). على وجه التحديد، فإن تناول BPC 157 داخل الصفاق بعد 10 دقائق من الإصابة يتصدى للآثار السلبية. على النقيض من ذلك، تستمر إصابة الحبل الشوكي وشلل الذيل في الفئران غير المعالجة، ويتم تقييمها بعد أيام وأسابيع وشهور وسنة من الإصابة. تجدر الإشارة إلى أن BPC 157 يخفف من الضرر الشائع. وبالتالي، يؤدي العلاج BPC 157 إلى انتعاش وظيفي ومجهري وكهربي واضح.



تجدر الإشارة إلى أنه في الفئران المصابة بإصابة في النخاع الشوكي، هناك ضخ دائم للدم. بمجرد إعطاء BPC 157 بعد 10 دقائق من إصابة ما بعد الضغط، تكون هناك حماية مستمرة ولا تظهر أي اضطرابات ناجمة عن إصابة الحبل الشوكي تلقائيًا. جميع إصابات الحبل الشوكي تثير النزيف على الفور، مع موت الخلايا العصبية والخلايا الدبقية قليلة التغصن لاحقًا.
ومن ثم، فمن المتصور أن الإرقاء المبكر قد يكون مفيدًا ويمكّن من التعافي الوظيفي بعد كدمة الحبل الشوكي في الفئران. ومع ذلك، فإن التأثير الذي يمارسه BPC 157 من المحتمل أن يختلف عن التأثير المرقئ البسيط الذي من شأنه أن يخفف من إصابة الحبل الشوكي، لأن BPC 157 يعمل أيضًا على تحسين وظيفة الصفيحات في الفئران بشكل ملحوظ دون التأثير على عوامل التخثر. أثناء التعافي من إصابة الحبل الشوكي، يحمي BPC 157 أيضًا البطانة بشكل مباشر، ويخفف من اضطرابات انسداد الأوعية الدموية الطرفية، وينشط بسرعة مسارات الالتفافية البديلة، ويقاوم المتلازمات الناجمة عن الانسداد الوريدي. وبالتالي، بافتراض أن هناك مساهمة وريدي كبيرة في ضغط الحبل الشوكي، فمن المتصور أن تدفق الدم المعاد تكوينه بوساطة BPC 157 قد يساهم بلا شك في تأثير التعافي السريع. علاوة على ذلك، مع الأخذ في الاعتبار أن BPC 157 يعزز ضخ الدم الدائم بعد ضغط الحبل الشوكي، تجدر الإشارة إلى أنه عندما يتم إعطاء BPC 157 أثناء إعادة ضخ الدم، فإنه يتصدى للسكتة الدماغية الناجمة عن التثبيت الثنائي للشرايين السباتية المشتركة. يعمل BPC 157 على حل تلف الخلايا العصبية ويمنع العجز في الذاكرة والحركية والتنسيق. يبدو أن BPC 157 يمارس هذه التأثيرات عن طريق تغيير التعبير الجيني في الحصين .
في الختام، BPC 157 يمارس تأثيرات مفيدة على السكتة الدماغية، والفصام، وإصابة النخاع الشوكي.
لقد أثبت الباحثون باستمرار أن BPC 157 يمارس عددًا لا يحصى من التأثيرات المفيدة في جميع أنحاء الجسم. لا يوجد سبب للإشارة إلى أن فوائد BPC 157 محدودة بصلاحية النماذج المستخدمة و/أو قيود المنهجية. في الواقع، يمكننا القول بأن الفعالية وسهولة التطبيق والملف السريري الآمن وآلية BPC 157 تمثل اتجاهًا علاجيًا بديلاً وناجحًا في المستقبل للحالات العصبية. لذلك، هناك حاجة لدراسات إضافية لتوضيح كيف سيتعامل العلاج المحتمل لـ BPC 157 على وجه التحديد مع آلية العمل التي تتضمن مواقع خلوية متعددة في الجهاز العصبي المركزي. ينبغي استكشاف التأثير على وظيفة معظم، إن لم يكن كل، الأنظمة العصبية على المستويات الجزيئية والخلوية والجهازية. بعض التتابعات الحشوية المتكررة للجهاز العصبي المركزي أو الأعضاء المحيطة بالبطينات، وهي إحدى المناطق القليلة في الدماغ التي لا يوجد بها حاجز دموي دماغي، هي مسار معروف يمكن من خلاله للببتيد المعطى جهازيًا أن يمارس تأثيرًا مركزيًا. وبالتالي، يجب أن يتصرف ضمن محور الأمعاء والدماغ، بغض النظر عما إذا كان هذا الفعل مباشرًا أو غير مباشر.
البيبستاتين هو خماسي الببتيد، وهو مثبط طبيعي للأسبارتيل الأنزيم البروتيني، والذي يمكن أن يثبط الأنزيم البروتيني الأسبارتيك والبروتياز الحمضي لمختلف الكائنات الحية الدقيقة. يتم إفراز البيبستاتين بشكل رئيسي بواسطة أنواع الستربتوميسيس ويتم إنتاجه بواسطة الستربتوميسيس. يمكن أن يثبط البيبسين والبيبسين د والإنزيم المطلق للأنجيوتنسين، وله تأثيرات علاجية على قرحة المعدة وارتفاع ضغط الدم الكلوي والتهاب المفاصل وذمة الكاراجينان وأمراض أخرى.
يعتبر البيبستاتين مثبطًا قويًا لبروتياز الأسبارتيل مثل البيبسين والكاثيبسين د والرينين. كان هذا الخماسي الببتيد الطبيعي المعزول من الفطريات الشعاعية لسنوات عديدة مثبط الرينين الكلاسيكي في المختبر. البيبستاتين ليس محددًا للرينين وهو ضعيف الذوبان في الماء. زادت المشتقات الهيكلية للبيبستاتين من قابليته للذوبان وخصوصيته للرينين بعدة أوامر من حيث الحجم. يحتوي البيبستاتين على حمض الستاتين غير العادي الذي قد يحل محل اثنين من الأحماض الأمينية في الرابطة القابلة للامتداد لركيزة البروتين وانشطار الركيزة بسبب التشابه الهيكلي مع الحالة الانتقالية للتحلل المائي لرابطة الببتيد بواسطة بروتياز الأسبارتيل.



عندما يتم استخلاص البروتين من الخلايا المكسورة، يمكن إطلاق البروتياز، والذي يجب تثبيطه بسرعة لمنع تحلل البروتين. في عملية استخلاص البروتين، يجب إضافة مثبطات الأنزيم البروتيني لمنع تحلل البروتينات. يشير مثبط الأنزيم البروتيني على نطاق واسع إلى مادة ترتبط ببعض المجموعات الموجودة في المركز النشط لجزيئات الأنزيم البروتيني، بحيث ينخفض نشاط الأنزيم البروتيني أو حتى يختفي، لكنه لا يفسد بروتين الإنزيم. تختلف حساسية البروتياز المختلفة للبروتينات المختلفة، لذلك من الضروري ضبط تركيز البروتيازات المختلفة. نظرًا لأن قابلية ذوبان مثبط الأنزيم البروتيني في السائل منخفضة للغاية، فيجب إيلاء اهتمام خاص لخلط مثبط الأنزيم البروتيني بالكامل في المخزن المؤقت لتقليل ترسيب مثبط الأنزيم البروتيني. يمكن للبيبستانتين A أن يثبط الأنزيم البروتيني الحمضي مثل البيبسين والأنجيوتنسين والكولاجيناز والكاثيبسين د والكيموسين.

Pepstatin A هو مثبط لكاثيبسين d و e. بعد معالجة خلايا HEK293 بتركيزات مختلفة من البيبستاتين A لمدة 24 ساعة، تم اكتشاف تعبير LC3Ⅱ وp62. أظهرت النتائج أن البيبستاتين A يمكن أن يعزز بشكل كبير التعبير عن LC3Ⅱ وP62 (P <0.05) بطريقة تعتمد على الجرعة. تم استخدام 20 ميكروغرام / مل من البيبستاتين A لعلاج HEK293 على فترات زمنية مختلفة، ولوحظت آثار فترات زمنية مختلفة على التعبير عن LC3II وp62. أظهرت النتائج أن البيبستاتين A يمكنه تنظيم التعبير عن LC3II وp62 بطريقة تعتمد على الوقت.
نحن شركة مصنعة للبولي ببتيد في الصين، مع عدة سنوات من الخبرة الناضجة في إنتاج البولي ببتيد. Hangzhou Taijia Biotech Co., Ltd. هي شركة متخصصة في تصنيع المواد الخام متعددة الببتيد، والتي يمكن أن توفر عشرات الآلاف من المواد الخام متعددة الببتيد ويمكن أيضًا تخصيصها وفقًا للاحتياجات. جودة منتجات البولي ببتيد ممتازة، ويمكن أن يصل النقاء إلى 98%، وهو ما تم الاعتراف به من قبل المستخدمين في جميع أنحاء العالم. مرحبًا بكم في استشارتنا.
كاجريلينتيد هو ببتيد اصطناعي يحاكي عمل الأميلين، وهو هرمون يفرزه البنكرياس وينظم مستويات الجلوكوز في الدم والشهية. وهو يتألف من 38 حمض أميني ويحتوي على رابطة ثاني كبريتيد. يرتبط كاجريلينتيد بكل من مستقبلات الأميلين (AMYR) ومستقبلات الكالسيتونين (CTR)، وهي مستقبلات مقترنة بالبروتين G يتم التعبير عنها في أنسجة مختلفة، مثل الدماغ والبنكرياس والعظام. من خلال تنشيط هذه المستقبلات، يمكن أن يقلل كاجريلينتيد من تناول الطعام، ويخفض مستويات الجلوكوز في الدم، ويزيد من إنفاق الطاقة. تم دراسة كاجريلينتيد كعلاج محتمل للسمنة، وهو اضطراب أيضي يتميز بزيادة الدهون في الجسم وزيادة خطر الإصابة بمرض السكري وأمراض القلب والأوعية الدموية والسرطان. أظهر كاجريلينتيد نتائج واعدة في الدراسات على الحيوانات والتجارب السريرية، مما يدل على فقدان كبير في الوزن وتحسين التحكم في نسبة السكر في الدم لدى المرضى الذين يعانون من السمنة المفرطة مع أو بدون مرض السكري من النوع 2.



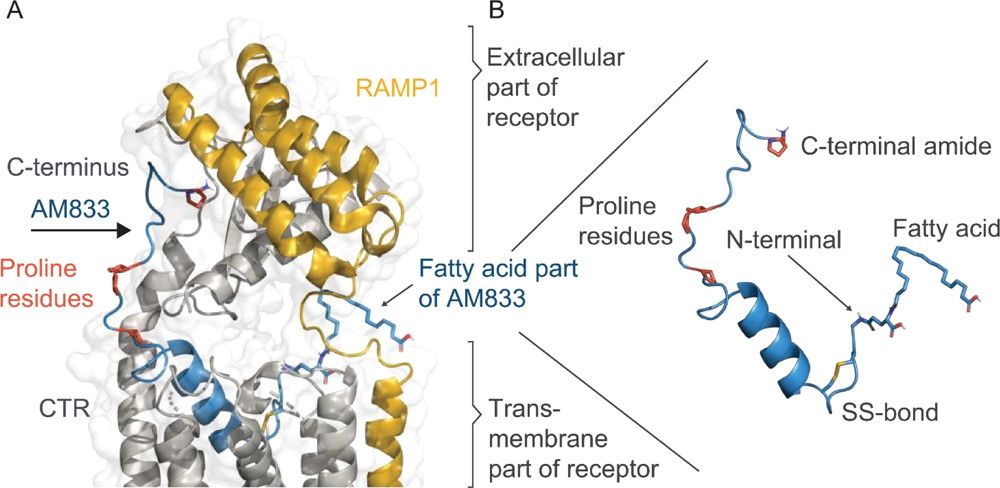
الشكل 1. نموذج التماثل للكاجريلينتيد (23) المرتبط بـ AMY3R. (أ) يتكون الجزء N- الطرفي من 23 (الأزرق) من حلزون a برمائي، مدفون بعمق في مجال TM الخاص بـ AMY3R، بينما من المتوقع أن يتبنى الجزء C-التشكل الممتد الذي يربط الجزء خارج الخلية من المستقبل. (29،30) تم تسليط الضوء على الأحماض الدهنية المرتبطة بالطرف N المكون من 23، بقايا البرولين (التي تقلل من الرجفان)، وأميد الطرف C (الضروري لربط المستقبلات) في تمثيلات العصا. يتم تشكيل AMY3R بواسطة نسبة النقر إلى الظهور (الرمادية) المرتبطة بـ RAMP3 (بروتين تعديل نشاط المستقبل 3؛ البرتقالي). تم إنشاء النموذج الهيكلي باستخدام هياكل القالب التالية: بنية معقدة لـ CGRP (مستقبل يشبه مستقبلات الكالسيتونين؛ كود pdb 6E3Y) وبنية بلورية apo للعمود الفقري 23 (رمز pdb 7BG0). (ب) تكبير 23 درجة لتسليط الضوء على رابطة ثاني كبريتيد N-terminal، وجسر ملح داخلي بين البقايا 14 و17، و"شكل سحاب الليوسين"، ورابطة هيدروجينية داخلية بين البقايا 4 و11. (مقتبس من Kruse T، Hansen JL، Dahl K، Schäffer L، Sensfuss U، Poulsen C، Schlein M، Hansen AMK، Jeppesen CB، Dornonville de la Cour C، Clausen TR، Johansson E، Fulle S، Skyggebjerg RB، Raun K. تطوير Cagrilintide، نظير الأميلين طويل المفعول. ي ميد كيم. 2021 12 أغسطس؛64(15):11183-11194.)
بعض التطبيقات البيولوجية للكاجريلينتيد هي:
يمكن أن يعدل كاجريلينتيد نشاط الخلايا العصبية في منطقة ما تحت المهاد، وهي منطقة الدماغ التي تتحكم في الشهية وتوازن الطاقة (Lutz et al., 2015, Front Endocrinol (لوزان)). يمكن أن يمنع كاجريلينتيد إطلاق الخلايا العصبية المنشأ، التي تحفز الجوع، وينشط الخلايا العصبية المسببة لفقد الشهية، التي تقمع الجوع. على سبيل المثال، يمكن أن يقلل كاجريلينتيد من التعبير عن الببتيد العصبي Y (NPY) والببتيد المرتبط بالأغوتي (AgRP)، وهما ببتيدان قويان المنشأ، ويزيد من التعبير عن البروبيوميلانوكورتين (POMC) والنسخة المنظمة للكوكايين والأمفيتامين (CART)، وهما ببتيدان فقدان الشهية، في النواة المقوسة في منطقة ما تحت المهاد (روث). وآخرون، 2018، فيسيول بيهاف). يمكن أن يعزز كاجريلينتيد أيضًا التأثير المشبع لليبتين، وهو الهرمون الذي يشير إلى حالة طاقة الجسم. يفرز اللبتين من الأنسجة الدهنية ويرتبط بمستقبلات اللبتين على الخلايا العصبية تحت المهاد، مما يثبط الخلايا العصبية الأصلية وينشط الخلايا العصبية فقدان الشهية. يمكن أن يزيد كاجريلينتيد من حساسية مستقبلات الليبتين ويحفز التنشيط الناجم عن الليبتين لمحول الإشارة ومنشط النسخ 3 (STAT3)، وهو عامل النسخ الذي يتوسط تأثيرات اللبتين على التعبير الجيني (Lutz et al., 2015, Front Endocrinol (لوزان)). هذه التأثيرات يمكن أن تقلل من تناول الطعام وتزيد من إنفاق الطاقة، مما يؤدي إلى فقدان الوزن.
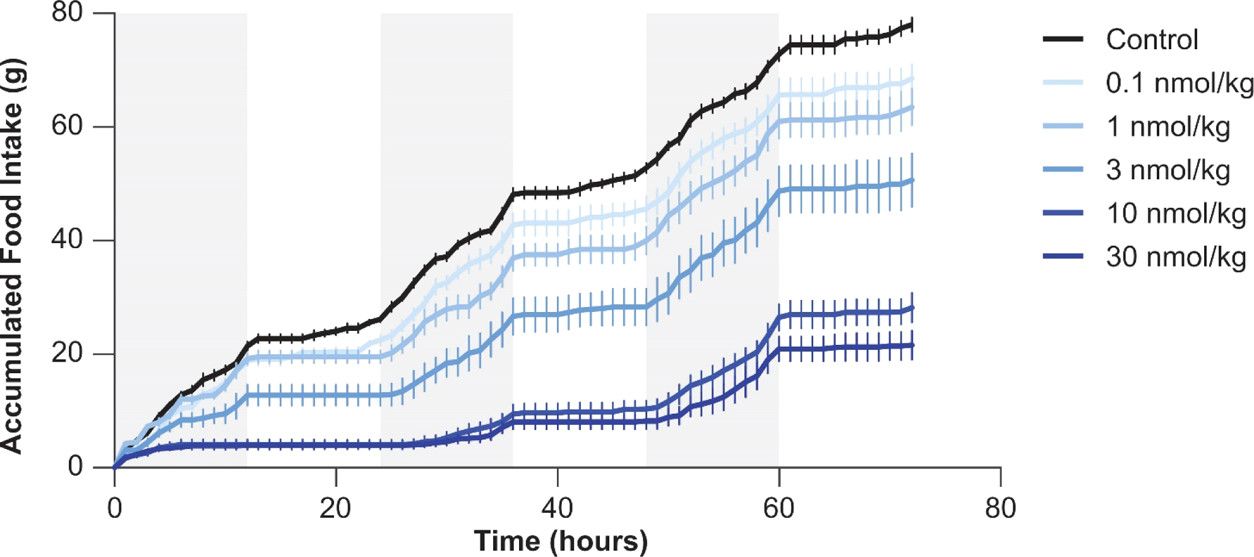
الشكل 2. تناول الطعام لدى الفئران بعد إعطاء Cagrilintide 23 تحت الجلد. (مقتبس من Kruse T، Hansen JL، Dahl K، Schäffer L، Sensfuss U، Poulsen C، Schlein M، Hansen AMK، Jeppesen CB، Dornonville de la Cour C، Clausen TR، Johansson E، Fulle S، Skyggebjerg RB، Raun ك. تطوير كاجريلينتيد، وهو نظير الأميلين طويل المفعول. ي ميد كيم. 2021 12 أغسطس؛64(15):11183-11194.)
يمكن أن ينظم كاجريلينتيد إفراز الأنسولين والجلوكاجون، وهما هرمونان يتحكمان في مستويات الجلوكوز في الدم. يمكن أن يمنع كاجريلينتيد إفراز الجلوكاجون من خلايا ألفا في البنكرياس، مما يمنع إنتاج الجلوكوز الزائد عن طريق الكبد. الجلوكاجون هو هرمون يحفز تحلل الجليكوجين وتخليق الجلوكوز في الكبد، مما يرفع مستويات الجلوكوز في الدم. يمكن أن يثبط كاجريلينتيد إفراز الجلوكاجون عن طريق الارتباط بمستقبلات الأميلين ومستقبلات الكالسيتونين على خلايا ألفا، والتي تقترن ببروتينات G المثبطة التي تقلل مستويات أحادي فوسفات الأدينوزين الحلقي (cAMP) وتدفق الكالسيوم. يمكن أن يعمل كاجريلينتيد أيضًا على تحفيز إفراز الأنسولين من خلايا بيتا في البنكرياس، مما يعزز امتصاص الجلوكوز عن طريق العضلات والأنسجة الدهنية. الأنسولين هو هرمون يعزز تخزين الجلوكوز على شكل جليكوجين في الكبد والعضلات، وتحويل الجلوكوز إلى أحماض دهنية في الأنسجة الدهنية، مما يخفض مستويات الجلوكوز في الدم. يمكن أن يعزز كاجريلينتيد إفراز الأنسولين عن طريق الارتباط بمستقبلات الأميلين ومستقبلات الكالسيتونين على خلايا بيتا، والتي تقترن ببروتينات G المحفزة التي تزيد من مستويات cAMP وتدفق الكالسيوم. يمكن لهذه التأثيرات خفض مستويات الجلوكوز في الدم وتحسين حساسية الأنسولين، مما يمكن أن يمنع أو يعالج مرض السكري من النوع 2 (Kruse et al., 2021, J Med Chem; Dehestani et al., 2021, J Obes Metab Syndr.).
يمكن أن يؤثر كاجريلينتيد أيضًا على وظيفة الخلايا العظمية العظمية والخلايا العظمية العظمية، وهما نوعان من الخلايا التي تشارك في تكوين العظام وامتصاصها. تكون الخلايا العظمية مسؤولة عن إنتاج مصفوفة عظمية جديدة، بينما تكون الخلايا العظمية مسؤولة عن تحطيم مصفوفة العظام القديمة. التوازن بين الخلايا العظمية والخلايا العظمية يحدد كتلة العظام وقوتها. يمكن أن يحفز كاجريلينتيد تمايز ونشاط الخلايا العظمية، مما يزيد من تكوين العظام. يمكن أن يرتبط كاجريلينتيد بمستقبلات الأميلين ومستقبلات الكالسيتونين على الخلايا العظمية، والتي تنشط مسارات الإشارات داخل الخلايا التي تعزز تكاثر الخلايا العظمية والبقاء على قيد الحياة وتوليف المصفوفة (كورنيش وآخرون، 1996، Biochem Biophys Res Commun. ). يمكن أن يزيد كاجريلينتيد أيضًا من التعبير عن الأوستيوكالسين، وهو علامة على نضوج الأرومة العظمية ووظيفتها (كورنيش وآخرون، 1996، Biochem Biophys Res Commun.). يمكن أن يمنع كاجريلينتيد أيضًا تمايز ونشاط الخلايا العظمية، مما يقلل من ارتشاف العظم. يمكن أن يرتبط كاجريلينتيد بمستقبلات الأميلين ومستقبلات الكالسيتونين على سلائف الخلايا العظمية، مما يمنع اندماجها في الخلايا العظمية الناضجة (كورنيش وآخرون، 2015). يمكن أن يقلل كاجريلينتيد أيضًا من التعبير عن حمض الفوسفاتيز المقاوم للطرطرات (TRAP)، وهو علامة على نشاط ناقضات العظم وارتشاف العظم (Cornish et al., 2015, Bonekey Rep.). يمكن لهذه التأثيرات تحسين كثافة المعادن في العظام ومنع أو علاج هشاشة العظام، وهي حالة تتميز بانخفاض كتلة العظام وزيادة خطر الكسر (Kruse et al., 2021; Dehestani et al., 2021, J Obes Metab Syndr.)
إنه مناسب للحقن داخل القراب وطرق العلاج الأخرى (مثل المسكنات الجهازية أو العلاج المساعد أو الغمد). زيكونوتيد هو مانع قنوات الكالسيوم قوي وانتقائي وقابل للعكس من النوع N حساس للجهد، وهو فعال في علاج الألم المقاوم للحرارة، ولا ينتج مقاومة للأدوية بعد تناوله على المدى الطويل، ولا يسبب الاعتماد الجسدي والعقلي، كما أنه لا يسبب اكتئاب الجهاز التنفسي الذي يهدد الحياة بسبب جرعة زائدة. الجرعة اليومية الموصى بها أقل، مع تأثير علاجي جيد، سلامة عالية، ردود فعل سلبية أقل، لا توجد مقاومة للأدوية والإدمان. يتمتع هذا المنتج بآفاق سوقية ضخمة كمسكن للألم.



وفقًا لإحصائيات غير كاملة، تبلغ نسبة حدوث الألم في العالم حوالي 35% ~ 45% حاليًا، كما أن نسبة حدوث الألم لدى كبار السن مرتفعة نسبيًا، حوالي 75% ~ 90%. وتظهر دراسة أمريكية أن حالات الصداع النصفي زادت من 23.6 مليون في عام 1989 إلى 28 مليون في عام 2001. وفي التحقيق في الألم المزمن في ست مدن في الصين، تبين أن حدوث الألم المزمن لدى البالغين يبلغ 40%، ومعدل العلاج الطبي 35%؛ تبلغ نسبة حدوث الألم المزمن لدى كبار السن 65% ~ 80%، ونسبة مراجعة الطبيب 85%. في السنوات الأخيرة، تتزايد النفقات الطبية لتخفيف الآلام سنة بعد سنة.
في الفترة من عام 2013 إلى يوليو 2015، أجرى مركز أبحاث الألم في الولايات المتحدة والعديد من المؤسسات الطبية دراسة رصدية طويلة الأمد ومتعددة المراكز حول حقن الزيكونوتيد داخل القراب لدى 93 مريضة بيضاء بالغة تعاني من آلام مزمنة شديدة. وتمت مقارنة مقياس درجة الألم الرقمي والنتيجة الحسية الشاملة للمرضى الذين يعانون من الحقن داخل القراب من الزيكونوتيد وبدون حقن الزيكونوتيد. من بينهم، استخدم 51 مريضا الحقن داخل القراب من الزيكونوتيد، في حين لم يفعل 42 مريضا ذلك. وكانت درجات الألم الأساسية 7.4 و 7.9 على التوالي. الجرعة الموصى بها للحقن داخل القراب من الزيكونوتيد كانت 0.5-2.4 ميكروغرام / يوم، والتي تم تعديلها وفقا لاستجابة المريض للألم والآثار الجانبية. كان متوسط الجرعة الأولية 1.6 ميكروغرام / يوم، و 3.0 ميكروغرام / يوم في 6 أشهر و 2.5 في 9 أشهر. في 12 شهرًا، كان 1.9 ميكروغرام / يوم، وبعد 6 أشهر، كان معدل الانخفاض 29.4٪، وكان معدل زيادة التباين 6.4٪، وكان معدل التحسن في النتيجة الحسية الإجمالية 69.2٪ و 35.7٪ على التوالي. وبعد 12 شهراً، كان معدل الانخفاض 34.4% و3.4% على التوالي، وكان معدل التحسن في النتيجة الحسية الإجمالية 85.7% و71.4% على التوالي. وكانت أعلى الآثار الجانبية هي الغثيان (19.6% و7.1%) والهلوسة (9.8% و11.9%) والدوخة (13.7% و7.1%). أكدت نتائج هذه الدراسة مرة أخرى فعالية وسلامة الزيكونوتيد الموصى به كخط أول للحقن داخل القراب.
يمكن إرجاع الدراسة الأولية للزيكونوتيد إلى الثمانينيات، عندما تم استكشاف التطبيق العلاجي المحتمل للببتيدات الصلبة والشبيهة بالبروتين في سم المخروط لأول مرة. هذه السموم الكونوتوكسينات عبارة عن ببتيدات صغيرة غنية بروابط ثاني كبريتيد، عادة ما يكون طولها 10-40 وحدة، لاستهداف القنوات الأيونية المختلفة، وGPCR والبروتينات الناقلة بكفاءة وانتقائية. Ziconotide عبارة عن 25 ببتيدًا مشتقًا من Conus magus، والذي يحتوي على ثلاث روابط ثاني كبريتيد، ويتم ترتيب طياته القصيرة مكانيًا في بنية ثلاثية الأبعاد فريدة من نوعها، مما يسمح له بتثبيط قنوات CaV2.2 بشكل انتقائي.
ليناكلوتيد هو ببتيد حلقي يتكون من 14 حمض أميني، ثلاثة منها عبارة عن سيستين تشكل روابط ثاني كبريتيد. يرتبط ليناكلوتيد هيكليًا بالببتيدات الذاتية غوانيلين وأوروغوانيلين، وهي روابط طبيعية لمستقبل غوانيلات سيكلاز C (GC-C). يتم التعبير عن مستقبل GC-C على السطح اللمعي للخلايا الظهارية المعوية، حيث ينظم إفراز السوائل وحركة الأمعاء. يرتبط ليناكلوتيد بمستقبل GC-C بألفة وخصوصية عالية، وينشطه عن طريق زيادة مستويات جوانوزين أحادي الفوسفات الحلقي (cGMP) داخل الخلايا. cGMP هو الرسول الثاني الذي يتوسط الاستجابات الخلوية المختلفة، مثل إفراز الكلوريد والبيكربونات، واسترخاء العضلات الملساء، وتعديل الألم. يعمل ليناكلوتيد موضعياً في الجهاز الهضمي، ولا يخترق حاجز الدم في الدماغ ولا يؤثر على الجهاز العصبي المركزي. ينتج ليناكلوتيد أيضًا مستقلبًا نشطًا، MM-419447، والذي له خصائص دوائية مماثلة لليناكلوتيد. كل من ليناكلوتيد ومستقلبه مقاومان للتحلل البروتيني بواسطة الإنزيمات المعوية، ويتم التخلص منهما بشكل أساسي دون تغيير في البراز (MacDonald et al., Drugs, 2017).
من خلال تنشيط مستقبل GC-C، يزيد ليناكلوتيد من إفراز السوائل في تجويف الأمعاء، مما يؤدي إلى تليين البراز وتسهيل حركات الأمعاء. كما يقلل ليناكلوتيد من فرط الحساسية والالتهابات الحشوية المرتبطة بمتلازمة القولون العصبي (IBS) واضطرابات الجهاز الهضمي الأخرى. ينظم ليناكلوتيد نشاط الجهاز العصبي المعوي ومستقبلات الألم القولونية، وهي خلايا عصبية حسية تنقل إشارات الألم من الأمعاء إلى الدماغ. يقلل ليناكلوتيد من التعبير عن الجينات المرتبطة بالألم، مثل المادة P والببتيد المرتبط بجين الكالسيتونين (CGRP)، ويزيد من التعبير عن المستقبلات الأفيونية، التي تتوسط التسكين. يقلل ليناكلوتيد أيضًا من إطلاق السيتوكينات المؤيدة للالتهابات، مثل إنترلوكين 1 بيتا (IL-1β) وعامل نخر الورم ألفا (TNF-α)، ويزيد من إطلاق السيتوكينات المضادة للالتهابات، مثل إنترلوكين 10 (IL-10) وعامل النمو المحول بيتا (TGF-β). تعمل تأثيرات الليناكلوتيد على تحسين أعراض الإمساك وآلام البطن لدى مرضى القولون العصبي أو الإمساك المزمن (Lembo et al.، The American Journal of Gastroenterology، 2018).
لقد ثبت أن ليناكلوتيد فعال وجيد التحمل في العديد من التجارب السريرية التي تشمل المرضى الذين يعانون من CC أو IBS-C. في هذه التجارب، أدى ليناكلوتيد إلى تحسين عادات الأمعاء، مثل تكرار البراز واتساقه واكتماله؛ تقليل آلام البطن وعدم الراحة. وتحسين نوعية الحياة ورضا المرضى. أظهر ليناكلوتيد أيضًا ملفًا آمنًا مناسبًا، حيث كان الإسهال هو الحدث الضار الأكثر شيوعًا. كانت الإصابة بالإسهال تعتمد على الجرعة وعادةً ما تكون خفيفة إلى متوسطة الشدة. وكانت الأحداث السلبية الأخرى مشابهة بشكل عام للعلاج الوهمي أو منخفضة التردد. لم تُعزى أي أحداث سلبية خطيرة أو وفيات إلى علاج ليناكلوتيد (Rao et al.، Clinical Gastroenterology and Hepatology، 2015).



ليناكلوتيد هو دواء جديد وفعال للمرضى الذين يعانون من CC وIBS-C الذين لم يستجيبوا بشكل جيد للعلاجات التقليدية. وهو يعمل عن طريق محاكاة عمل الببتيدات الداخلية التي تنظم وظيفة الأمعاء والإحساس. يمكن لليناكلوتيد تحسين عادات الأمعاء وتقليل آلام البطن وتحسين نوعية الحياة لهؤلاء المرضى.

الشكل 1. آلام البطن/الانزعاج في البطن ودرجة IBS من الراحة للمستجيبين الأسبوعيين على مدار 12 أسبوعًا. ، الدواء الوهمي، ليناكلوتيد 290 ميكروغرام.
(Yang, Y., Fang, J., Guo, X., Dai, N., Shen, X., Yang, Y., Sun, J., Bhandari, B. R., Reasner, D. S., Cronin, J. A., Currie, MG, Johnston, J. M., Zeng, P., Montreewasuwat, N., Chen, G. Z., and Lim, S. (2018) ليناكلوتيد في القولون العصبي متلازمة الإمساك: تجربة عشوائية من المرحلة الثالثة في الصين ومناطق أخرى. مجلة أمراض الجهاز الهضمي والكبد، 33: 980-989. دوى: 10.1111/jgh.14086.)
نحن شركة مصنعة للبولي ببتيد في الصين، مع عدة سنوات من الخبرة الناضجة في إنتاج البولي ببتيد. Hangzhou Taijia Biotech Co., Ltd. هي شركة متخصصة في تصنيع المواد الخام متعددة الببتيد، والتي يمكن أن توفر عشرات الآلاف من المواد الخام متعددة الببتيد ويمكن أيضًا تخصيصها وفقًا للاحتياجات. جودة منتجات البولي ببتيد ممتازة، ويمكن أن يصل النقاء إلى 98%، وهو ما تم الاعتراف به من قبل المستخدمين في جميع أنحاء العالم. مرحبًا بكم في استشارتنا.
رقم سجل المستخلصات الكيميائية: 910463-68-2
الصيغة الجزيئية: C187H291N45O59
الوزن الجزيئي: 4113.64
التسلسل: His-Aib-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Tyr-Leu-Glu-Gly-Gln-Ala-Ala-N6-[N-(17-carboxy-1-oxoheptadecyl-L-γ-glutamyl[2-(2-aminoethoxy)ethoxy] أسيتيل [2- (2-أمينويثوكسي) إيثوكسي] أسيتيل] -Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Arg-Gly-Arg-Gly-OH
التطبيق: نظير الببتيد البشري طويل المفعول الشبيه بالجلوكاجون -1 (GLP-1) المستخدم لعلاج مرض السكري.
أسيتيل هيكساببتيد -8، المعروف أيضًا باسم أكيريلين وهيكسابيبتيد. يُطلق على أسيتيل هيكسابيبتيد -8 أيضًا اسم "ذيفان البوتولينوم الشبيه"/"ذيفان البوتولينوم اللطاخة" من قبل العديد من الأشخاص. يمكن القول أن الأكويلين عبارة عن بولي ببتيد مضاد للتجاعيد وله تأثير أفضل من توكسين البوتولينوم.



كما نعلم جميعًا، فإن توكسين البوتولينوم هو منتج تجميلي يحتاج إلى الحقن. إنه أمر خطير للغاية للاستخدام، ويجب استخدامه من قبل المتخصصين. يجب التحكم في الجرعة بشكل صارم، لكنها لا تزال غير قادرة على تجنب الآثار الجانبية المختلفة مثل تصلب الوجه وشلل الوجه.
تم التحقق من Argireline في التجارب البشرية لمصنعي مستحضرات التجميل: انخفض متوسط عمق التجاعيد بنسبة 16.9% و27.0% بعد 15 و30 يومًا باستخدام محلول Argireline 10%، وانخفض حجم التجاعيد بنسبة 20.6% وانخفض طول التجاعيد بنسبة 15.9% بعد 7 أيام فقط مع محلول Argireline 2%. يمكن ملاحظة أن تأثير الأشيلرين على التجاعيد مهم جدًا.

التجاعيد في جلد الوجه البشري تنتج في الغالب عن استرخاء الكولاجين والتقلص اللاإرادي للعضلات. إذا أمكن التحكم في انقباض هذه العضلات، يمكن استرخاء عضلات الجلد لتخفيف التجاعيد وتحقيق الغرض الأساسي وهو إزالة التجاعيد.
توكسين البوتولينوم، كوسيلة فعالة لإزالة التجاعيد، معروف على نطاق واسع بتأثيره الممتاز. وحتى لو كان سيسبب مخاطر كبيرة بعد استخدامه، فسيظل هناك عدد كبير من المستهلكين الراغبين في استخدامه. البولي ببتيد مختلف. كمنتج اصطناعي عضوي، عند استخدامه كمكون تجميلي، يمكن أن يتحلل بسرعة إلى أحماض أمينية حرة بتركيز منخفض. يعتمد تسلسلها الرئيسي على جسم الإنسان وآلية عملها طبيعية. إن خصائص الببتيدات الجزيئية الصغيرة تمكنها من الحصول على نفاذية جيدة عبر الجلد ويتم امتصاصها جيدًا من قبل جسم الإنسان. يمنع الأسيتيل هيكسابيبتيد -8 العصب من نقل معلومات تقلص العضلات من خلال آلية مشابهة لتوكسين البوتولينوم، بحيث لا تتمكن العضلات من الانقباض للقضاء على التجاعيد. له نشاط عالي مضاد للتجاعيد وآثار جانبية قليلة، وقد تم استخدامه على نطاق واسع في العديد من مستحضرات التجميل الراقية.

نحن شركة مصنعة للبولي ببتيد في الصين، مع عدة سنوات من الخبرة الناضجة في إنتاج البولي ببتيد. Hangzhou Taijia Biotech Co., Ltd. هي شركة متخصصة في تصنيع المواد الخام متعددة الببتيد، والتي يمكن أن توفر عشرات الآلاف من المواد الخام متعددة الببتيد ويمكن أيضًا تخصيصها وفقًا للاحتياجات. جودة منتجات البولي ببتيد ممتازة، ويمكن أن يصل النقاء إلى 98%، وهو ما تم الاعتراف به من قبل المستخدمين في جميع أنحاء العالم. مرحبًا بكم في استشارتنا.
تخليق الببتيد في المرحلة الصلبة
تقنية SPPS الحديثة لإنتاج ببتيدات عالية الجودة تصل إلى 150 حمضًا أمينيًا
توليف مرحلة الحل
التوليف المخصص للببتيدات المعقدة التي تتطلب منهجيات مرحلة الحل
تعديل الببتيد
الخبرة في تعديلات الببتيد المختلفة بما في ذلك الغليكوزيل، PEGylation، والتدوير
الاختبار التحليلي
توصيف شامل للببتيد باستخدام HPLC وMS وNMR وغيرها من التقنيات المتقدمة
في الوقت الحاضر، يمكننا توفير: الببتيدات السكرية، والببتيدات ذات العلامات النظائرية، والببتيدات المخلبة كبيرة الحلقات، وببتيدات المستضدات المعقدة MAPS، والتي تستخدم في مختلف الأبحاث العلمية؛ يتم تطبيق جميع أنواع الببتيدات ذات العلامات الفلورية لتحديد نشاط الإنزيم ودراسة المجسات الجزيئية؛ انقر فوق الببتيد الكيميائي، والببتيد المعدل من البولي إيثيلين جلايكول، والببتيد الحلقي، والببتيد المخترق للخلايا، والتي يتم تطبيقها على أبحاث أدوية البولي ببتيد المختلفة لتحسين نصف عمر ونشاط أدوية البولي ببتيد.
حقوق النشر © 2025 لشركة هانغتشو هوتيد للتكنولوجيا الحيوية المحدودة. جميع الحقوق محفوظة.